Реакции присоединения. Химические свойства бензола и его гомологов Уравнение реакции бензола с азотной кислотой
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах , но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.

Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.

Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.

Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.

Третье свойство алкилирование бензола галогеналканами.

Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.

Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке гидрирование, присоединение водорода.
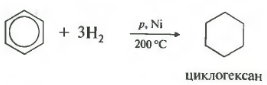
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.
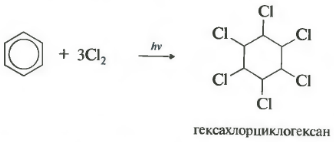
Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.

Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.

Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.

В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.

Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
Циклическую структуру бензола впервые предложил Ф.А. Кекуле в 1865 г.

Фридрих Август Кекуле фон Страдониц - выдающийся немецкий химик XIX в. В 1854 г. он обнаружил первое органическое соединение, содержащее серу - тиоуксусную кислоту (тиоэтановую кислоту). Кроме того, он установил структуру диазосоединений. Олнако его наиболее известным вкладом в развитие химии является установление структуры бензола (1866). Кекуле показал, что двойные связи бензола чередуются по кольцу (эта идея впервые возникла у него во сне). Позже он показал, что два возможных расположения двойных связей идентичны и что бензольное кольцо представляет собой гибрид между этими двумя структурами. Таким образом, он предвосхитил представление о резонансе (мезомерии), которое появилось в теории химической связи в начале 1930-х гг.
Если бы бензол действительно имел такую структуру, то его 1,2-дизамещенные производные должны были иметь по два изомера. Например,

Однако ни у одного из 1,2-дизамещенных бензолов не удается выделить два изомера.
Поэтому впоследствии Кекуле предположил, что молекула бензола существует как две быстро переходящие друг в друга структуры:

Заметим, что в таких схематических изображениях молекул бензола и их производных обычно не указываются атомы водорода, присоединенные к углеродным атомам бензольного кольца.
В современной химии молекулу бензола рассматривают как резонансный гибрид из этих двух предельных резонансных форм (см. разд. 2.1). Другое описание молекулы бензола основано на рассмотрении ее молекулярных орбиталей. В разд. 3.1 было указано, что -электроны, находящиеся на -связывающих орбиталях, делокализованы между всеми атомами углерода бензольного кольца и образуют -электронное облако. В соответствии с таким представлением молекулу бензола можно условно изобразить следующим образом:
Экспериментальные данные подтверждают наличие у бензола именно такой структуры. Если бы бензол имел структуру, которую предположил первоначально Кекуле, с тремя сопряженными двойными связями, то бензол должен был вступать в реакции присоединения подобно алкенам. Однако, как было уже указано выше, бензол не вступает в реакции присоединения. Кроме того, бензол обладает большей устойчивостью, чем если бы он имел три изолированные двойные связи. В разд. 5.3 было указано, что энтальпия гидрирования бензола с образованием циклогексана имеет большее отрицательное
Таблица 18.3. Длина различных углерод-углеродных связей


Рис. 18.6. Геометрическое строение молекулы бензола.
значение, чем утроенная энтальпия гидрирования циклогексена. Разность этих величин принято называть энтальпией делокализации, резонансной энергией или энергией стабилизации бензола.
Все углерод-углеродные связи в бензольном кольце имеют одинаковую длину, которая меньше, чем длина связей С-С в алканах, но больше, чем длина связей С=С в алкенах (табл. 18.3). Это служит подтверждением тому, что углерод-углеродные связи в бензоле представляют собой гибрид между простыми и двойными связями.
Молекула бензола имеет плоскую структуру, которая изображена на рис. 18.6.
Физические свойства
Бензол при нормальных условиях - бесцветная жидкость, которая замерзает при 5,5 °С и кипит при 80 °С. Он имеет характерный приятный запах, но, как указывалось выше, сильно токсичен. Бензол не смешивается с водой и в системе бензол вода образует верхний из двух слоев. Однако он растворяется в неполярных органических растворителях и сам является хорошим растворителем других органических соединений.
Химические свойства
Хотя бензол вступает в определенные реакции присоединения (см. ниже), он не проявляет в них типичной для алкенов реакционной способности. Например, он не обесцвечивает бромную воду или раствор -ионов. Кроме того, бензол не
вступает в реакции присоединения с сильными кислотами, например с соляной или серной кислотой.
Вместе с тем бензол принимает участие в целом ряде реакций электрофильного замещения. Продуктами реакций этого типа являются ароматические соединения, поскольку в этих реакциях сохраняется делокализованная -электронная система бензола. Общий механизм замещения атома водорода на бензольном кольце каким-либо электрофилом описан в разд. 17.3. Примерами электрофильного замещения бензола являются его нитрование, галогенирование, сульфирование и реакции Фриделя-Крафтса.
Нитрование. Бензол можно нитровать (вводить в него группу ), обрабатывая его смесью концентрированных азотной и серной кислот:

Нитробензол
Условия проведения этой реакции и ее механизм описаны в разд. 17.3.
Нитробензол бледно-желтая жидкость с характерным миндальным запахом. При нитровании бензола кроме нитробензола образуются еще кристаллы 1,3-динитробензола, который является продуктом следующей реакции:

Галогенирование. Если смешать бензол в темноте с хлором или бромом, не произойдет никакой ракции. Однако в присутствии катализаторов, обладающих свойствами кислот Льюиса, в таких смесях протекают реакции электрофильного замещения. Типичными катализаторами этих реакций являются бромид железа (III) и хлорид алюминия. Действие этих катализаторов заключается в том, что они создают поляризацию в молекулах галогенов, которые затем образуют комплекс с катализатором:
хотя прямых доказательств того, что при этом образуются свободные ионы не существует. Механизм бромирования бензола с помощью бромида железа (III) в роли переносчика ионов можно представить следующим образом:

Сульфирование. Бензол можно сульфировать (замещать в нем атом водорода на сульфогруппу) путем кипячения с обратным холодильником в течение нескольких часов его смеси с концентрированной серной кислотой. Вместо этого бензол можно осторожно нагревать в смеси с дымящей серной кислотой. Дымящая серная кислота содержит триоксид серы. Механизм этой реакции можно представить схемой

Реакции Фриделя-Крафтса. Реакциями Фриделя-Крафтса первоначально называли реакции конденсации между ароматическими соединениями и алкилгалогенидами в присутствии катализатора-безводного хлорида алюминия.
В реакциях конденсации две молекулы реагентов (или одного реагента) соединяются между собой, образуя молекулу нового соединения, при этом от них отщепляется (элиминирует) молекула какого-либо простого соединения, например воды или хлороводорода.
В настоящее время реакцией Фриделя-Крафтса называют любое электрофильное замещение ароматического соединения, в котором роль электрофила играет какой-либо карбкатион или сильно поляризованный комплекс с положительно заряженным атомом углерода. Электрофильным агентом, как правило, служит алкилгалогенид или хлорид какой-либо карбоновой кислоты, хотя точно так же им может быть, например, алкен либо спирт. В качестве катализатора этих реакций обычно используется безводный хлорид алюминия. Реакции Фриделя-Крафтса принято подразделять на два типа: алкилирование и ацилирование.
Алкилирование. В реакциях Фриделя-Крафтса этого типа происходит замещение одного или нескольких атомов водорода в бензольном кольце на алкильные группы. Например, при осторожном нагревании смеси бензола с хлорометаном в присутствии безводного хлорида алюминия образуется метилбензол. Хлорометан играет в этой реакции роль электрофильного агента. Он поляризуется хлоридом алюминия таким же образом, как это происходит с молекулами галогенов:
Механизм рассматриваемой реакции может быть представлен следующим образом:

Следует обратить внимание на то, что в этой реакции конденсации между бензолом и хлорометаном происходит отщепление молекулы хлороводорода. Отметим также, что реальное существование метального карбкатиона в виде свободного иона сомнительно.
Алкилирование бензола хлорометаном в присутствии катализатора - безводного хлорида алюминия не завершается образованием метилбензола. В этой реакции происходит дальнейшее алкилирование бензольного кольца, приводящее к образованию 1,2-диметилбензола:

Ацилирование. В реакциях Фриделя-Крафтса этого типа происходит замещение атома водорода в бензольном кольце на ацильную группу, в результате чего образуется ароматический кетон.
Ацильная группа имеет общую формулу
Систематическое название ацильного соединения образуется путем замены суффикса и окончания -овая в названии соответствующей карбоновой кислоты, производным которой является данное ацилъное соединение, на суффикс -(о) ил. Например

Ацилирование бензола проводится с помощью хлорида или ангидрида какой-либо карбоновой кислоты в присутствии катализатора-безводного хлорида алюминия. Например

Эта реакция представляет собой конденсацию, в которой происходит отщепление молекулы хлороводорода. Отметим также, что название «фенил» часто используется для обозначения бензольного кольца в соединениях, где бензол не является главной группой:

Реакции присоединения. Хотя для бензола наиболее характерны реакции электрофильного замещения, он вступает также в некоторые реакции присоединения. С одной из них мы уже познакомились. Речь идет о гидрировании бензола (см. разд. 5.3). При пропускании смеси бензола с водородом над поверхностью тонкоизмельченного никелевого катализатора при температуре 150-160 °С происходит целая последовательность реакций, которая завершается образованием циклогексана. Суммарное стехиометрическое уравнение этой реакции можно представить следующим образом:

Под действием ультрафиолетового излучения или прямого солнечного света бензол вступает также в реакцию присоединения с хлором. Эта реакция осуществляется по сложному радикальному механизму. Ее окончательным продуктом является 1,2,3,4,5,6-гексахлороциклогексан:

Аналогичная реакция протекает между бензолом и бромом под действием ультрафиолетового излучения или солнечного света.
Окисление. Бензол и бензольное кольцо в других ароматических соединениях, вообще говоря, устойчивы к окислению даже такими сильными окислителями, как кислый или щелочный раствор перманганата калия. Однако бензол и другие ароматические соединения сгорают в воздухе или в кислороде с образованием очень дымного пламени, что характерно для углеводородов с высоким относительным содержанием углерода.
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
К ароматическим соединениям, или аренам, относится большая группа соединений, молекулы которых содержат устойчивую циклическую группировку (бензольное кольцо), обладающую особыми физическими и химическими свойствами.
К таким соединениям относятся прежде всего бензол и его многочисленные производные.
Термин "ароматические" вначале использовался применительно к продуктам природного происхождения, которые имели ароматный запах. Поскольку среди этих соединений было много таких, которые включали бензольные кольца, термин "ароматические" стали применять к любым соединениям (в том числе имеющих и неприятный запах), содержащих бензольное кольцо.
Бензол, его электронное строение
По формуле бензола С 6 Н 6 можно предположить, что бензол является сильно ненасыщенным соединением, аналогичным, например, ацетилену. Однако химические свойства бензола не подтверждают такого предположения. Так, при обычных условиях, бензол не дает реакций, характерных для непредельных углеводородов: не вступает в реакции присоединения с галогенводородами, не обесцвечивает раствор марганцево-кислого калия. В то же время бензол вступает в реакции замещения аналогично предельным углеводородам.
Эти факты говорят о том, что, бензол частично сходен с предельными, частично с непредельными углеводородами и в то же время отличается от тех и других. Поэтому в течение длительного времени между учеными происходили оживленные дискуссии по вопросу о строении бензола.
В 60-е гг. прошлого столетия большинство химиков признали теорию циклического строения бензола на основании факта, что однозамещенные производные бензола (например, бромбензол) не имеют изомеров.
Наибольшее признание получила формула бензола, предложенная в 1865 г. немецким химиком Кекуле, в которой двойные связи в кольце углеродных атомов бензола чередуются с простыми, причем, по гипотезе Кекуле, простые и двойные связи непрерывно перемещаются:
Однако формула Кекуле не может объяснить, почему бензол не проявляет свойств непредельных соединений.
Согласно современным представлениям молекула бензола имеет строение плоского шестиугольника, стороны которого равны между собой и составляют 0,140 нм. Это расстояние является средним значением между величинами 0,154 нм (длина одинарной связи) и 0,134 нм (длина двойной связи). Не только углеродные атомы, но и связанные с ними шесть атомов водорода лежат в одной плоскости. Углы, образованные связями Н - С - С и С - С - С равны 120 °.

Атомы углерода в бензоле находятся в sр 2 -гибрндизации, т.е. из четырех орбиталей атома углерода гибридизированными являются только три (одна 2s- и две 2 р-), которые принимают участие в образовании σ-связей между углеродными атомами. Четвертая 2 р-орбиталь перекрывается с 2 р -орбиталями двух соседних углеродных атомов (справа и слева), шесть делокализованных π-электронов, находящихся на гантелеобразных орбиталях, оси которых перпендикулярны плоскости бензольного кольца, образуют единую устойчивую замкнутую электронную систему.
В результате образования замкнутой электронной системы всеми шестью углеродными атомами, происходит "выравнивание" простых и двойных связей, т.е. в молекуле бензола отсутствуют классические двойные и одинарные связи. Равномерное распределение π-электронной плотности между всеми углеродными атомами и является причиной высокой устойчивости молекулы бензола. Чтобы подчеркнуть выравненность π-электронной плотности в молекуле бензола, прибегают к такой формуле:

Номенклатура и изомерия ароматических углеводородов ряда бензола
Общая формула гомологического ряда бензола С n Н 2 n -6 .
Первый гомолог бензола - метилбензол, или толуол, С 7 Н 8

не имеет изомеров положения, как и все другие однозамещенные производные.
Второй гомолог С 8 Н 10 может существовать в четырех изомерных формах: этилбензол С 6 Н 5 -С 2 Н 5 и три диметилбензола, или ксилола, С б Н 4 (СН 3) 2 (орто-, мета- и пара -ксилолы, или 1,2-, 1,3- и 1,4-диметилбензолы):

Радикал (остаток) бензола С 6 Н 5 - носит название фенил ; названия радикалов гомологов бензола производят от названий соответствующих углеводородов, добавляя к корню суффикс -ил (толил, ксилил и т. д.) и обозначая буквами (о-, м-, п-) или цифрами положение боковых цепей. Общее название для всех ароматических радикалов арилы аналогично названию алкилы для радикалов алканов. Радикал С 6 Н 5 -СН 2 - называется бензил.
Называя более сложные производные бензола из возможных порядков нумерации выбирают тот, при котором сумма цифр номеров заместителей будет наименьшей. Например, диметил этил бензол строения

следует назвать1,4-диметил-2-этилбензол (сумма цифр равна 7), а не 1,4-диметил-6-этилбензол (сумма цифр равна 11).
Названия высших гомологов бензола часто производят не от названия ароматического ядра, а от названия боковой цепи, т. е. рассматривают их как производные алканов:

Физические свойства ароматических углеводородов ряда бензола
Низшие члены гомологического ряда бензола представляют собой бесцветные жидкости с характерным запахом. Плотность и показатель преломления у них значительно выше, чем у алканов и алкенов. Температура плавления тоже заметно выше. Из-за высокого содержания углерода все ароматические соединения горят сильно коптящим пламенем. Все ароматические углеводороды нерастворимы в воде и хорошо растворимы в большинстве органических растворителей: многие из них хорошо перегоняются с водяным паром.
Химические свойства ароматических углеводородов ряда бензола
Для ароматических углеводородов наиболее характерны реакции замещения водорода в ароматическом кольце. В реакции присоединения ароматические углеводороды вступают с большим трудом при жестких условиях. Отличительной особенностью бензола является его значительная стойкость по отношению к окислителям.
Реакции присоединения
Присоединение водорода
В отдельных редких случаях бензол способен к реакциям присоединения. Гидрирование, т. е. присоединение водорода, происходит при действии водорода в жестких условиях в присутствии катализаторов (Ni, Pt, Pd). При этом молекула бензола присоединяет три молекулы водорода с образованием циклогексана:

Присоединение галогенов
Если раствор хлора в бензоле подвергнуть действию солнечного света или ультрафиолетовых лучей, то происходит радикальное присоединение трех молекул галогена с образованием сложной смеси стереоизомеров гексахлорциклогексана:

Гексахлорциклогексаи (товарное название гексахлоран) в настоящее время находит применение как инсектицид - вещества, уничтожающие насекомых, являющихся вредителями сельского хозяйства.
Реакции окисления
Бензол еще более стоек к действию окислителей, чем предельные углеводороды. Он не окисляется разбавленной азотной кислотой, раствором КМпО 4 и т.д. Гомологи бензола окисляются значительно легче. Но и в них бензольное ядро относительно более устойчиво к действию окислителей, чем соединенные с ним углеводородные радикалы. Существует правило: любой гомолог бензола с одной боковой цепью окисляется в одноосновную (бензойную) кислоту:
Гомологи бензола с несколькими боковыми цепями любой сложности окисляются с образованием многоосновных ароматических кислот:

Реакции замещения
1. Галогенирование
В обычных условиях ароматические углеводороды практически не реагируют с галогенами; бензол не обесцвечивает бромной воды, но в присутствии катализаторов (FeCl 3 , FеВг 3 , АlCl 3) в безводной среде хлор и бром энергично вступают в реакцию с бензолом при комнатной температуре:

Реакция нитрования
Для реакции применяют концентрированную азотную кислоту, часто в смеси с концентрированной серной кислотой (катализатор):

В незамещенном бензоле реакционная способность всех шести атомов углерода в реакциях замещения одинакова; заместители могут присоединяться к любому углеродному атому. Если же в бензольном ядре уже имеется заместитель, то под его влиянием состояние ядра изменяется, и положение, в которое вступает любой новый заместитель, зависит от природы первого заместителя. Из этого следует, что каждый заместитель в бензольном ядре проявляет определенное направляющее (ориентирующее) влияние и способствует введению новых заместителей лишь в определенные по отношению к себе положения.
По направляющему влиянию различные заместители подразделяются на две группы:
а) заместители первого рода:
Они направляют любой новый заместитель в орто- и пара-положения по отношению к себе. При этом они почти все уменьшают устойчивость ароматической группировки и облегчают как реакции замещения, так и реакции бензольного ядра:

б) заместители второго рода:
Они направляют любой новый заместитель в мета-положение по отношению к себе. Они увеличивают устойчивость ароматической группировки и затрудняют реакции замещения:

Таким образом, ароматический характер бензола (и других аренов) выражается в том, что это соединение, по составу являясь непредельным, в целом ряде химических реакций проявляет себя как предельное соединение, для него характерны химическая устойчивость, трудность реакций присоединения. Только в особых условиях (катализаторы, облучение) бензол ведет себя так, как будто в его молекуле имеются три двойные связи.
с чем взаимодействует бензол и их уравнения реакции
- аиболее характерны для них реакции замещения атомов водорода бензольного ядра. Они протекают легче, чем у предельных углеводородов. Таким путем получают множество органических соединений. Так, при взаимодействии бензола с бромом (в присутствии катализатора FеВr2) атом водорода замещается атомом брома:
При другом катализаторе можно все атомы водорода в бензоле заместить на галоген. Это происходит, например, при пропускании в бензол хлора в присутствии хлорида алюминия:
Гексахлорбензол - бесцветное кристаллическое вещество, применяемое для протравливания семян и консервирования древесины.
Если на бензол действовать смесью концентрированных азотной и серной кислот (нитрующей смесью) , то атом водорода замещается нитрогруппой NО2:
В молекуле бензола можно заместить атом водорода на алкильный радикал действием галогенопроизводных углеводородов в присутствии хлорида алюминия:
Реакции присоединения к бензолу протекают с большим трудом. Для их протекания необходимы особые условия: повышение температуры и давления, подбор катализатора, световое облучение и др. Так, в присутствии катализатора - никеля или платины - бензол гидрируется, т. е. присоединяет водород, образуя циклогексан:
При ультрафиолетовом облучении бензол присоединяет хлор:
Гексахлорциклогексан, или гексахлоран, - кристаллическое вещество, применяется как сильное средство для уничтожения насекомых.
Бензол не присоединяет галогеноводороды и воду. Он очень устойчив к окислителям. В отличие от непредельных углеводородов он не обесцвечивает бромную воду и раствор KMnO4. В обычных условиях бензольное кольцо не разрушается и при действии многих других окислителей. Однако гомологи бензола подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом:
Таким образом, ароматические углеводороды могут вступать как в реакции замещения, так и в реакции присоединения, однако условия этих превращений значительно отличаются от аналогичных превращений предельных и непредельных углеводородов.
Получение. Бензол и его гомологи в больших количествах получают из нефти и каменноугольной смолы, образующейся при сухой перегонке каменного угля (коксовании) . Сухая перегонка производится на коксохимических и газовых заводах.
Реакция превращения циклогексана в бензол (дегидрогенизация или дегидрирование) протекает при пропускании его над катализатором (платиновой чернью) при 300С. Предельные углеводороды реакцией дегидрогенизации также можно превращать в ароматические. Например:
Реакции дегидрирования позволяют использовать углеводороды нефти для получения углеводородов ряда бензола. Они указывают на связь между различными группами углеводородов и на взаимное превращение их друг в друга.
По способу Н. Д. Зелинского и Б. А. Казанского бензол можно получить, пропуская ацетилен через нагретую до 600 С трубку с активированным углем. Весь процесс полимеризации трех молекул ацетилена можно изобразить схемой
- 1)реакция замещения
а) в присутствии катализатора-солей железа (III) - бензол вступает в реакцию замещения:
C6H6+Br2=C6H5Br+Рик
аналогично бензол реагирует и с хлором
б) к реакциям замещения относяться так же взаимодействие бензола с азотной кислотой:
C6H6+HONO2=C6H5NO2+H2O
2)РЕАКЦИЯ ПРИСОЕДИНЕНИЯ
А) при действии солнечного света ли ультрафиолетовых лучей бензол встуает в реакции присоединения. Например, бензол на свету присоединяет хром и образует гексахлорциклогексан:
C6H6+3Cl2=C6H6Cl6
б) бензол способен также гидрироваться:
C6HC+3H2=C6H12
3)РЕАКЦИИ ОКИСЛЕНИЯ
а) при действии энергичных окислителей (КMnO4)на гомологи бензола окислению подвергаються только боковые цепи.
C6H5-CH3+3O=C7H6O2+H2O
б) бензол и его гомологи на воздухе горят пламенем:
2C6H6+15O2=12CO2+6H2O
Среди разнообразных реакций, в которые вступают ароматические соединения с участием бензольного кольца, в первую очередь обращают на себя внимание рассмотренные выше реакции замещения. Это происходит, потому что они протекают вопреки ожиданиям. При той степени ненасыщенности, которая присуща, например, бензолу, этому углеводороду более характерными должны были быть реакции присоединения. При определенных условиях так и происходит, бензол и другие арены присоединяют водородные атомы, галогены, озон и другие способные присоединяться реагенты.
11.5.5. Гидрирование. В присутствии катализаторов гидрирования (платина, палладий, никель) бензол и его гомологи присоединяют водород и превращаются в соответствующие циклогексаны. Так, бензол гидрируется над никелевым катализатором при 100-200 0 C и 105 атм.:
Гидрирование аренов по сравнению с алкенами имеет две особенности. Во-первых, арены значительно уступают алкенам в реакционной способности . Для сравнения с условиями гидрирования бензола укажем, что циклогексен гидрируется в циклогексан уже при 25 0 C и давлении в 1,4 атм. Во-вторых, бензол или не присоединяет, или присоединяет сразу три молекулы водорода . Получить гидрированием бензола продукты частичного гидрирования, такие как циклогексен или циклогексадиен, не удается.
Эти особенности при гидрировании, частном случае реакций присоединения к бензольному кольцу, обусловлены строением бензола. При превращении в циклогексан бензол перестает быть ароматической системой. Циклогексан содержит на 150,73 кДж энергии больше (энергия резонанса) и менее устойчив, чем бензол. Понятно, что перейти в это термодинамически менее устойчивое состояние бензол не склонен. Этим и объясняется меньшая реакционная способность бензола по отношению к водороду по сравнению с алкенами. Присоединение к ароматической системе возможно лишь с участием р -электронов единого электронного облака бензольного кольца. С началом процесса присоединения система перестает быть ароматической и получается богатая энергией и обладающая высокой реакционной способностью частица, которая гораздо охотнее вступает в реакцию присоединения, чем исходный арен.
11.5.6. Галогенирование. Результат взаимодействия галогена с бензолом зависит от экспериментальных условий. Каталитическое галогенирование ведет к образованию продуктов замещения. Оказалось, что ультрафиолет инициирует присоединение атомов галогена к бензольному ядру аренов. Сам бензол на свету присоединяет 6 атомов хлора и превращается в гесахлорциклогексан, представляющий смесь 9 пространственных изомеров
Один из этих изомеров, в котором 3 хлора занимают аксиальные связи, а еще 3 – экваториальные связи (γ-изомер, гексахлоран), оказался эффективным инсектицидом, средством борьбы с вредными насекомыми. Гексахлоран оказался слишком устойчивым в условиях биосферы и способным накапливаться в жировой ткани теплокровных и поэтому в настоящее время не применяется.
По своей реакционной способности по отношению к галогенам в реакциях присоединения бензол значительно уступает алкенам. Например, хлор и бром в четыреххлористом углероде даже в темноте при комнатной температуре присоединяются к циклогексену. В указанных условиях бензол не реагирует. Происходит это только при ультрафиолетовом освещении.
11.5.7. Озонирование. Озонирование - еще один пример, показывающий, что бензол как ненасыщенное соединение может вступить в реакцию присоединения. Озонирование бензола и изучение продуктов гидролиза триозонида было осуществлено еще в 1904 году (Гарриес )
Интересные результаты были получены при озонировании о -ксилола (1941 г., Вибо ). Дело в том, что состав продуктов озонирования зависит от положения двойных связей в бензольном кольце. Структура 1 с двойными связями между углеродами бензольного кольца, несущими метильные заместители, при озонировании и гидролизе озонида даст 2 молекулы метилглиоксаля и молекулу глиоксаля
Альтернативная структура II для о -ксилола должна была бы образовать 2 молекулы глиоксаля и молекулу диацетила