Удельная теплота кипения. Определение удельной теплоты парообразования
На этом уроке мы уделим внимание такому виду парообразования, как кипение, обсудим его отличия от рассмотренного ранее процесса испарения, введем такую величину, как температура кипения, и обсудим, от чего она зависит. В конце урока введем очень важную величину, описывающую процесс парообразования - удельную теплоту парообразования и конденсации.
Тема: Агрегатные состояния вещества
Урок: Кипение. Удельная теплота парообразования и конденсации
На прошлом уроке мы уже рассмотрели один из видов парообразования - испарение - и выделили свойства этого процесса. Сегодня мы обсудим такой вид парообразования, как процесс кипения, и введем величину, которая численно характеризует процесс парообразования - удельная теплота парообразования и конденсации.
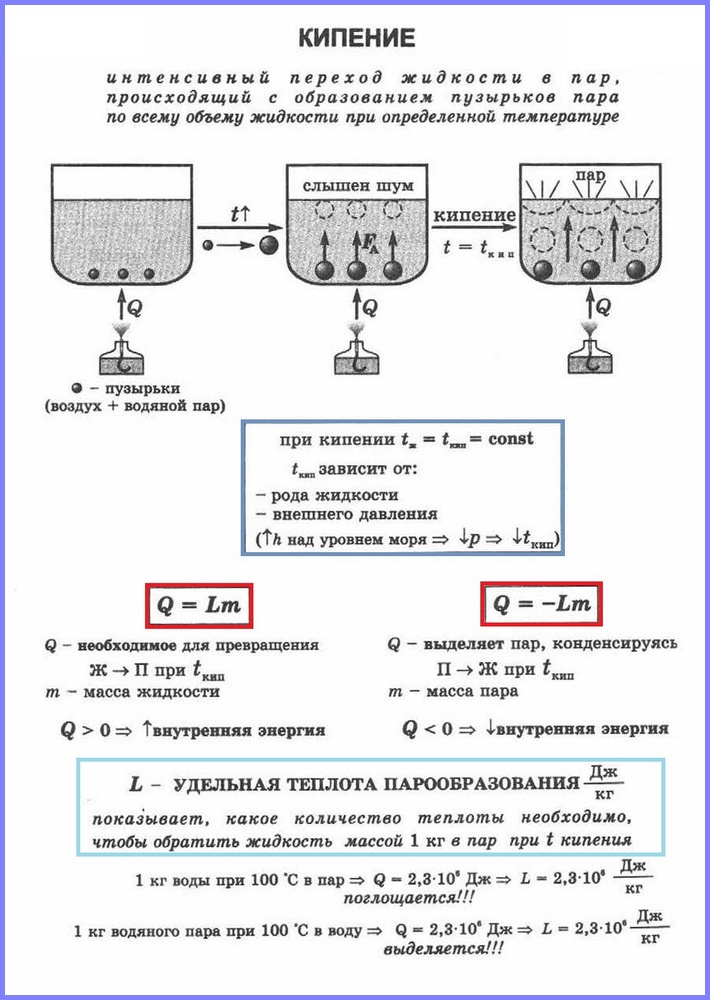
Определение. Кипение (рис. 1) - это процесс интенсивного перехода жидкости в газообразное состояние, сопровождающийся образованием пузырьков пара и происходящий по всему объему жидкости при определенной температуре, которую называют температурой кипения.
Сравним два вида парообразования между собой. Процесс кипения более интенсивен, чем процесс испарения. Кроме того, как мы помним, процесс испарения протекает при любой температуре выше температуры плавления, а процесс кипения - строго при определенной температуре, которая является различной для каждого из веществ и называется температурой кипения. Еще следует отметить, что испарение происходит только со свободной поверхности жидкости, т. е. с области, разграничивающей ее с окружающими газами, а кипение - сразу со всего объема.
Более подробно рассмотрим протекание процесса кипения. Представим ситуацию, с которой многие из нас неоднократно сталкивались, - это нагревание и кипячение воды в некотором сосуде, например, в кастрюле. В ходе нагревания воде будет передаваться определенное количество теплоты, что будет приводить к увеличению ее внутренней энергии и увеличению активности движения молекул. Этот процесс будет протекать до определенного этапа, пока энергия движения молекул не станет достаточной для начала кипения.
В воде присутствуют растворенные газы (или другие примеси), которые выделяются в ее структуре, что приводит к так называемому возникновению центров парообразования. Т. е. именно в этих центрах начинает происходить выделение пара, и по всему объему воды образовываются пузырьки, которые наблюдаются при кипении. Важно понимать, что в этих пузырьках находится не воздух, а именно пар, который образовывается в процессе кипения. После образования пузырьков количество пара в них растет, и они начинают увеличиваться в размерах. Зачастую, изначально пузырьки образуются вблизи стенок сосуда и не сразу поднимаются на поверхность; сначала они, увеличиваясь в размерах, оказываются под воздействием нарастающей силы Архимеда, а затем отрываются от стенки и поднимаются на поверхность, где лопаются и высвобождают порцию пара.
Стоит отметить, что далеко не сразу все пузырьки пара достигают свободной поверхности воды. В начале процесса кипения вода прогрета еще далеко не равномерно и нижние слои, вблизи которых происходит непосредственно процесс теплопередачи, еще горячее верхних, даже с учетом процесса конвекции. Это приводит к тому, что поднимающиеся снизу пузырьки пара схлопываются из-за явления поверхностного натяжения, еще не доходя до свободной поверхности воды. При этом пар, который находился внутри пузырьков, переходит в воду, тем самым дополнительно нагревая ее и ускоряя процесс равномерного прогрева воды по всему объему. В результате, когда вода прогревается практически равномерно, почти все пузырьки пара начинают достигать поверхности воды и начинается процесс интенсивного парообразования.
Важно выделить тот факт, что температура, при которой проходит процесс кипения, остается неизменной даже в том случае, если увеличивать интенсивность подвода тепла к жидкости. Простыми словами, если в процессе кипения прибавить газ на конфорке, которая разогревает кастрюлю с водой, то это приведет только к увеличению интенсивности кипения, а не к увеличению температуры жидкости. Если углубляться более серьезно в процесс кипения, то стоит отметить, что в воде возникают области, в которых она может быть перегрета выше температуры кипения, но величина такого перегрева, как правило, не превышает одного-пары градусов и незначительна в общем объеме жидкости. Температура кипения воды при нормальном давлении составляет 100°С.
В процессе кипения воды можно заметить, что он сопровождается характерными звуками так называемого бурления. Эти звуки возникают как раз из-за описанного процесса схлопывания пузырьков пара.
Процессы кипения других жидкостей протекают аналогичным образом, что и кипение воды. Основное отличие в этих процессах составляют различные температуры кипения веществ, которые при нормальном атмосферном давлении являются уже измеренными табличными величинами. Укажем основные значения этих температур в таблице.
Интересен тот факт, что температура кипения жидкостей зависит от величины атмосферного давления, поэтому мы и указывали, что все значения в таблице приведены при нормальном атмосферном давлении. При возрастании давления воздуха возрастает и температура кипения жидкости, при уменьшении, наоборот, уменьшается.
На этой зависимости температуры кипения от давления окружающей среды основан принцип работы такого известного кухонного прибора, как скороварка (рис. 2). Она представляет собой кастрюлю с плотно закрывающейся крышкой, под которой в процессе парообразования воды давление воздуха с паром достигает значения до 2 атмосферных давлений, что приводит к увеличению температуры кипения воды в ней до . Из-за этого вода с продуктами в ней имеют возможность нагреться до температуры выше, чем обычно (), и процесс приготовления ускоряется. Из-за такого эффекта устройство и получило свое название.

Рис. 2. Скороварка ()
Ситуация с уменьшением температуры кипения жидкости с понижением атмосферного давления также имеет пример из жизни, но уже не повседневной для многих людей. Относится такой пример к путешествиям альпинистов в высокогорных районах. Оказывается, что в местности, находящейся на высоте 3000-5000 м, температура кипения воды из-за уменьшения атмосферного давления снижается до и более низких значений, что приводит к сложностям при приготовлении пищи в походах, т. к. для эффективной термической обработки продуктов в таком случае требуется значительно большее время, чем при нормальных условиях. На высотах около 7000 м температура кипения воды доходит до , что приводит к невозможности приготовления многих продуктов в таких условиях.
На том, что температуры кипения различных веществ отличаются, основаны некоторые технологии разделения веществ. Например, если рассматривать нагревание нефти, которая представляет собой сложную жидкость, состоящую из множества компонентов, то в процессе кипения ее можно будет разделить на несколько различных веществ. В данном случае, благодаря тому, что температуры кипения керосина, бензина, лигроина и мазута различны, их можно отделить друг от друга путем парообразования и конденсации при различных температурах. Такой процесс, как правило, называют разделением на фракции (рис. 3).

Рис. 3 Разделение нефти на фракции ()
Как и любой физический процесс, кипение необходимо характеризовать с помощью какой-то численной величины, такую величину называют удельной теплотой парообразования.
Для того чтобы понять физический смысл этой величины, рассмотрим следующий пример: возьмем 1 кг воды и доведем ее до температуры кипения, затем замерим, какое количество теплоты необходимо для того, чтобы полностью испарить эту воду (без учета тепловых потерь) - эта величина и будет равна удельной теплоте парообразования воды. Для другого вещества это значение теплоты будет другим и будет являться удельной теплотой парообразования этого вещества.
Удельная теплота парообразования оказывается очень важной характеристикой в современных технологиях производства металлов. Оказывается, что, например, при плавлении и испарении железа с его последующей конденсацией и затвердеванием образуется кристаллическая решетка с такой структурой, которая обеспечивает более высокую прочность, чем исходный образец.
Обозначение : удельная теплота парообразования и конденсации (иногда обозначается ).
Единица измерения : .
Удельная теплота парообразования веществ определяется с помощью экспериментов в лабораторных условиях, и ее значения для основных веществ занесены в соответствующую таблицу.
|
Вещество |
Приборы и принадлежности, используемые в работе:
2. Паропровод (резиновая трубка).
3. Калориметр.
4. Электроплитка.
5. Термометр.
6. Технические весы с разновесом.
7. Мензурка.
Цель работы:
Научиться опытным путем определять удельную теплоту парообразования воды.
I. ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ.
В процессе обмена энергией, между веществом и окружающей средой возможен переход вещества из одного агрегатного состояния в другое (из одного фазового состояния в другое).
Переход вещества из жидкого состояния в газообразное называется парообразованием.
Парообразование происходит в виде испарения и кипения.
Парообразование, которое происходит только со свободной поверхности жидкости, называется испарением .
Испарение происходит при любой температуре жидкости, но с повышением температуры скорость испарения жидкости возрастает.
Испаряющаяся жидкость может охлаждаться, если к ней не подводится интенсивно теплота извне, или нагреваться, теплота извне подводится интенсивно.
Парообразование, которое происходит по всему объему жидкости и при постоянной температуре, называется кипением.
Температура кипения зависит от внешнего давления на поверхность жидкости.
Температура кипения жидкости при нормальном атмосферном давлении называется точкой кипения данной жидкости.
При парообразовании внутренняя энергия вещества увеличивается, поэтому для превращения жидкости в пар к ней надо подводить теплоту в процессе теплообмена.
Количество теплоты , необходимое для превращения жидкости в пар при неизменной температуре, называется теплотой парообразования.
Величина прямо пропорциональна массе жидкости, превращенной в пар:
Величина g, характеризующая зависимость теплоты парообразования от рода вещества и от внешних условий, называется удельной теплотой парообразования . Удельная теплота парообразования измеряется количеством теплоты, необходимым для превращения в пар единицы массы жидкости при неизменной температуре:

В СИ удельная теплота парообразования измеряется в .
Величина зависит от температуры, при которой происходит парообразование. Опыт показывает, что при повышении температуры удельная теплота парообразования уменьшается. На приведенном графике (рис. 1) показана зависимость от для воды.
В данной работе определяется удельная теплота парообразования воды с помощью процесса кипения, используя уравнение теплового баланса при конденсации водяного пара. Для этого берут калориметр (К) (см. рис. 2), в котором находится вода при температуре , водяной пар, имеющий температуру кипения , из колбы по паропроводу П вводится в холодную воду калориметра, где он конденсируется.
Через некоторое время трубку паропровода вынимают и измеряют температуру , установившуюся в калориметре и определяют массу введённого в калориметр пара.

Затем составляется уравнение теплового баланса.
При конденсации пара массой , выделяется теплота .
где - удельная теплота конденсации (она же удельная теплота парообразования). Сконденсировавшийся пар превращается в воду при температуре , которая затем, остывая до температуры , выделит теплоту .
![]() (4)
(4)
Выделяемую при конденсации пара и охлаждения горячей воды теплоту получает калориметр и вода в нём. За счёт этого они нагреваются от температуры , до температуры . Теплота, полученная калориметром и холодной водой, в нём вычисляется по формуле:
Уравнение теплового баланса составляется в соответствии с законом сохранения энергии при теплообмене.
При теплообмене сумма количеств теплоты, отданных всеми телами, у которых внутренняя энергия уменьшается, равна сумме количеств теплоты, полученных всеми телами, у которых внутренняя энергия увеличивается:
![]() (6)
(6)
В нашем случае для теплообмена, который произошёл в калориметре, считаем, что потерь тепла в окружающую среду нет. Поэтому уравнение (6) запишем в виде: или
Из этого уравнения получаем рабочую формулу для вычисления величины по результатам опыта:
2. ХОД РАБОТЫ.
1. Составить таблицу, в которую будут заноситься результаты измерений и вычислений по форме, приведенной в конце описания.
2. Взвесить внутренний сосуд калориметра, полученное значение занести в таблицу.
3. С помощью мензурки отмерить 150 200 мл холодной воды налить её в калориметр и измерить массу внутреннего сосуда калориметра с водой (m 2). Найти массу воды:
m в = m 2 – m к
Массу холодной воды записать в таблицу.
4. Измерить начальную температуру калориметра и воды в нём Значение , записать в таблицу.
5. Опустить наконечник паропровода в воду калориметра и впускать пар до тех пор, пока температура воды не повысится на 30°К - 35°К (q-температура после теплообмена).
6. Взвесить внутренний стакан калориметра и определить массу сконденсированного пара. Полученный результат запишите в таблицу. ()
7. Значения удельных теплоёмкостей воды и вещества калориметра (алюминия) и табличное значение удельной теплоты парообразования воды даны в таблице результатов измерений и вычислений.
8. По формуле (7) вычислить удельную теплоту парообразования воды.
9. Вычислить абсолютную и относительную погрешность полученного результата относительно табличного результата по формулам:
; ![]()
10. Сделать вывод о проделанной работе и полученном результате удельной теплоты парообразования воды.
ТАБЛИЦА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ И ВЫЧИСЛЕНИЙ
Удельная теплоемкость
Удельная теплоемкость - это количество тепла в Джоулях (Дж), необходимое для повышения температуры вещества. Удельная теплоемкость является функцией температуры. Для газов необходимо проводить различие между удельной теплоемкостью при постоянном давлении и при постоянном объеме.
Удельная теплота плавления
Удельная теплота плавления твердого вещества - это количество тепла в Дж, необходимое для перевода 1 кг вещества из твердого состояния в жидкое при температуре плавления.
Скрытая теплота парообразования
Скрытая теплота парообразования жидкости - это количество тепла в Дж, необходимое для испарения 1 кг жидкости при температуре кипения. Скрытая теплота парообразования сильно зависит от давления. Пример: если к емкости, содержащей 1 кг воды при 100С (на уровне моря) подвести тепло, вода поглотит 1023 кДж скрытого тепла без какого-либо изменения в показаниях термометра. Однако, произойдет изменение агрегатного состояния из жидкости в пар. Поглощенное водой тепло называется скрытой теплотой парообразования. Пар сохранит 1023 кДж, поскольку эта энергия требовалась для изменения агрегатного состояния.
Скрытая теплота конденсации
При обратном процессе, когда тепло отводится от 1 кг водяного пара при 100С (на уровне моря), пар выделит 1023 кДж тепла без изменения в показаниях термометра. Однако, произойдет изменение агрегатного состояния из пара в жидкость. Поглощенное водой тепло называется скрытой теплотой конденсации.
Температура и давление

Тепловые измерения
Температура, или ИНТЕНСИВНОСТЬ тепла, измеряется термометром. Большинство значений температуры в данном руководстве приводятся в градусах Цельсия (С), однако иногда используются и градусы Фаренгейта (F). Значение температуры говорит только об интенсивности тепла или о ЯВНОМ ТЕПЛЕ, а не о действительном количестве тепла. Комфортная температура для человека находится в пределах от 21 до 27С. В этом диапазоне температур человек чувствует себя наиболее комфортно. Когда любая температура выше или ниже этого диапазона, человек воспринимает это как теплое или холодное. В науке существуют понятие «абсолютный ноль» - температура, при которой от тела отведено все тепло. Температура абсолютного нуля определяется как –273°C. Любое вещество при температуре выше абсолютного нуля содержит некоторое количество тепла. Для понимания основ кондиционирования воздуха также необходимо понимать связь между давлением, температурой и агрегатным состоянием. Наша планета окружена воздухом, иначе говоря газом. Давление в газе передается во всех направлениях одинаково. Окружающий нас газ состоит на 21% из кислорода и на 78% из азота. Остающийся 1% занимают другие редкие газы. Эта комбинация газов называется атмосферой. Она простирается на несколько сотен километров над земной поверхностью и удерживается силой гравитации. На уровне моря атмосферное давление составляет 1,0 бар, а точка кипения воды - 100С. В любой точке выше уровня моря атмосферное давление ниже, а также ниже температура кипения воды. При понижении давления до 0,38 бар, температура кипения воды составляет 75С, а при давлении 0,12 бар - 50С. Если на точку кипения воды влияет уменьшение давления, логично предположить, что увеличение давления также на нее повлияет. Пример - пароварочный котел!
Дополнительная информация: как перевести градусы Фаренгейта в градусы Цельсия и наоборот: C = 5/9 × (F – 32). F = (9/5 × C)+32. Кельвин = C + 273. Ренкин = F + 460.
цель работы
Усвоение и закрепление теоретического материала по теме курса термодинамики "Водяной пар", а также овладение методами эксперимента и обработки полученных данных, ознакомление с таблицами "Теплофизические свойства воды и водяного пара".
1. Изучить схему экспериментальной установки, включить её и вывести на заданный стационарный тепловой режим.
2. Провести опыт в соответствии с методическими указаниями, заполнить таблицу 1.
3. Определить удельную теплоту, затраченную на парообразование воды в опыте.
4. Для изобарного процесса парообразования определить табличные значения параметров воды на линии насыщения и сухого насыщенного пара, а также удельную теплоту парообразования.
5. Вычислить внутреннюю энергию жидкости на линии насыщения пара для условий опыта.
6. Вычислить погрешность найденного значения удельной теплоты парообразования по отношению к табличному.
7. Изобразить процессы, происходящие в сосуде Дьюара, в Р-v и T-s-диаграммах.
8. Сделать вывод по работе.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Переход вещества из жидкого состояния в газообразное, называется парообразованием, обратный переход - конденсацией. Кипение жидкости - это процесс парообразования внутри жидкости, происходящий при строго определенной температуре t н, °C, определяемой давлением. Если газообразная фаза существует с жидкой фазой того же вещества, то её называют паром. Газообразной фазой системы является сухой насыщенный пар, а жидкой фазой - жидкость, сохраняющая состояние, соответствующее началу парообразования.
При парообразовании по изобарно-изотермическому процессу, согласно первому закону термодинамики, удельная теплота фазового превращения (удельная теплота парообразования) r, Дж/кг,
r = u" - u" + p (v" -v"), (1)
r = i" - i", (2)
где u", i", v" - соответственно внутренняя энергия, энтальпия, Дж/кг, и удельный объём сухого насыщенного пара, м 3 /кг;
u", i", v" - соответственно внутренняя энергия, энтальпия, Дж/кг, и удельный объём жидкости в состоянии насыщения, м 3 /кг.
Давление р, Па, не отмечается специальными индексами, так как оно не меняется в течение всего фазового перехода и равно давлению насыщения.
Таким образом, удельная теплота парообразования включает в себя изменение внутренней энергии вещества и работу изменения объёма при фазовом переходе.
Удельная теплота парообразования функционально связана с параметрами состояния. Для большинства применяющихся на практике веществ определены и сведены в таблицы свойства жидкости и пара на линии насыщения. В этих таблицах приводятся значения р и t на линии насыщения и соответствующие им значения величин v", v", i", i", r, s", s". Внутренняя энергия жидкости на линии насыщения u", Дж/кг, и сухого насыщенного пара u", Дж/кг, определится соответственно по уравнениям
u" = i" -pv" (3)
u" = i" -pv" (4)
ЭКСПЕРИМЕНТАЛЬНАЯ УСТАНОВКА
Рисунок. Схема экспериментальной установки
Экспериментальная установка (рисунок) состоит из сосуда Дьюара 1 с электронагревателем 2, в который из емкости 3 наливается порция дистиллированной воды, регулируемая вентилем 4. Образующийся пар в конденсаторе 5, по которому проходит водопроводная вода, превращается в жидкость. Расход воды регулируется вентилем 7 по контрольному фонарю 8. Образующийся конденсат собирается в мерный цилиндр 9. На щите управления находятся: переключатель "СЕТЬ" 10, вольтметр 11, амперметр 12, переключатель режимов 13; 6 - стеклянная воронка.
МЕТОДИКА ПРОВЕДЕНИЯ ОПЫТА
1. Включить установку в сеть поворотом переключателя 10 в положение "1".
2. Проверить заполнение сосуда Дьюара 1, установив переключатель режимов 13 в положение "ЗАПОЛНЕНИЕ". Если при этом загорится зеленая сигнальная лампа "Сосуд заполнен", можно приступать к выполнению эксперимента. В противном случае сосуд заполняется дистиллированной водой, для чего открывается вентиль 4. После загорания зеленой сигнальной лампы сосуд плотно закрыть.
3. Перевести переключатель 13 в положение "НАГРЕВАНИЕ".
4. Поворачивая ручку автотрансформатора 14, установить заданное преподавателем значение напряжения на нагревателе U, В (и силу тока I, А).
5. Подать охлаждающую воду на конденсатор 5, открыв вентиль 7 и отрегулировать расход воды по контрольному фонарю 8.
6. При установлении стационарного режима кипения воды в сосуде Дьюара (в мерном цилиндре 9 наберется 15-20 см конденсата) произвести контрольный сбор конденсата в количестве, указанном преподавателем (V, м 3). Продолжительность контрольного сбора t, с, определить по секундомеру.
7. По барометру определить атмосферное давление P a , мм.рт.ст.
8. Данные измерений внести в таблицу наблюдений и подписать ее у преподавателя.
9. Включить установку поворотом переключателя "0", закрыть вентиль 7, рукоятку автотрансформатора повернуть против часовой стрелки до упора, конденсат слить в емкость 3.
Т а б л и ц а 1
|
Номер замера |
мм. рт. ст. | ||||
ОБРАБОТКА ОПЫТНЫХ ДАННЫХ
1. Вычислить количество теплоты, затраченной на парообразование 1 кг воды r оп, Дж/кг:
r оп = (W - Q) / (Vr),
где W = UI - мощность нагревателя, Вт;
Q = 0,04W - тепловые потери, Вт;
r - плотность конденсата, кг/ м 3 . Принимаем r = 1000 кг/ м 3 .
2. Считая, что кипение воды происходит при атмосферном давлении, определить по табличные значения параметров воды на линии насыщения и сухого насыщенного пара, которые занести в таблицу 2.
Т а б л и ц а 2
|
i", кДж/кг |
S", кДж/(кгК) |
i", кДж/кг |
S", Дж/(кгK) | |||
3. Вычислить значения внутренней энергии воды на линии насыщения u" и сухого насыщенного пара u", кДж/кг, по формулам (3) и (4).
4. Вычислить погрешность, %, найденного значения удельной теплоты парообразования r оп, кДж/кг, по отношению к табличному r, кДж/кг, по формуле:
D = (r оп - r) 100 / r .
5. Представить графически процессы, происходящие в сосуде Дьюара, в Р-v и T-s-диаграммах.
6. Сделать вывод по работе.
ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ
1. Парообразование жидкости; сущность процессов кипения и испарения жидкости.
2. Изобарный процесс перехода жидкости в перегретый пар в Р-v и T-s-диаграммах.
3. Пограничные кривые со степенью сухости х = 0 и х = 1, критическое состояние вещества
4. Понятия: жидкость на линии насыщения, влажный насыщенный пар, сухой насыщенный пар, перегретый пар.
5. Удельная теплота парообразования жидкости.
6. Степень сухости, степень влажности пара.
7. Таблицы теплофизических свойств воды и водяного пара, их значение.
8. Определение параметров влажного пара.
9. i-s-диаграмма водяного пара, ее назначение.
10. Паровые термодинамические процессы в Р-v, T-s, i-s-диаграммах.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Теплотехника / Под ред. А.П.Баскакова.- М.: Энергоиздат, 1991.- 224 с.
2. Нащокин В.В. Техническая термодинамика и теплопередача.- М.:: Высшая школа, 1980.- 496 с.
3. Юдаев Б.Н. Техническая термодинамика. Теплопередача.- М.: Высшая школа, 1998.- 480 с.
4. Ривкин С.Л., Александров А.А. Таблицы теплофизических свойств воды и водяного пара.- М.: Энергия, 1980.- 408 с.
Явление превращения вещества из жидкого состояния в газообразное называется парообразованием . Парообразование может осуществляться в виде двух процессов: и.
Кипение
Второй процесс парообразования - кипение. Наблюдать этот процесс можно с помощью простого опыта, нагревая воду в стеклянной колбе. При нагревании воды в ней через некоторое время появляются пузырьки, в которых содержатся воздух и насыщенный водяной пар, который образуется при испарении воды внутри пузырьков. При повышении температуры давление внутри пузырьков растёт, и под действием выталкивающей силы они поднимаются вверх. Однако, поскольку температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться, и они сжимаются. Когда вода прогреется по всему объёму, пузырьки с паром поднимаются до поверхности, лопаются, и пар выходит наружу. Вода кипит. Это происходит при такой температуре, при которой давление насыщенного пара в пузырьках равно атмосферному давлению.
Процесс парообразования, происходящий во всем объёме жидкости при определённой температуре, называют . Температуру, при которой жидкость кипит, называют температурой кипения .
Эта температура зависит от атмосферного давления. При повышении атмосферного давления температура кипения возрастает.
Опыт показывает, что в процессе кипения температура жидкости не изменяется, несмотря на то, что извне поступает энергия. Переход жидкости в газообразное состояние при температуре кипения связан с увеличением расстояния между молекулами и соответственно с преодолением притяжения между ними. На совершение работы по преодолению сил притяжения расходуется подводимая к жидкости энергия. Так происходит до тех пор, пока вся жидкость не превратится в пар. Поскольку жидкость и пар в процессе кипения имеют одинаковую температуру, то средняя кинетическая энергия молекул не изменяется, увеличивается лишь их потенциальная энергия.
На рисунке приведён график зависимости температуры воды от времени в процессе её нагревания от комнатной температуры до температуры кипения (АВ), кипения (ВС), нагревания пара (CD), охлаждения пара (DE), конденсации (EF) и последующего охлаждения (FG).
Удельная теплота парообразования
Для превращения разных веществ из жидкого состояния в газообразное требуется разная энергия, эта энергия характеризуется величиной, называемой удельной теплотой парообразования.
Удельная теплота парообразования (L ) — это величина, равная отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения.
Единица удельной теплоты парообразования - [L ] = Дж/кг.
Чтобы рассчитать количество теплоты Q, которое необходимо сообщить веществу массой тп для его превращения из жидкого состояния в газообразное, необходимо удельную теплоту парообразования (L ) умножить на массу вещества: Q = Lm.
При конденсации пара выделяется некоторое количество теплоты, причем его значение равно значению количества теплоты, которое необходимо затратить для превращения жидкости в пар при той же температуре.